Актуальные проблемы 21 века: мужское бесплодие, ожирение, дефицит витамина D – есть ли взаимосвязь?
Человечество толстеет и теряет репродуктивные способности
АВТОРЫ
Павлова З.Ш. - 1.,
Калинченко С.Ю. - 1.,
Камалов А.А. - 2.,
Тишова Ю.А. - 1.,
Жуйков А.В. - 1.,
Гусакова Д.А. - 1.
1 - Кафедра эндокринологии ФПК МР (зав. кафедрой – профессор С.Ю. Калинченко),
Государственное учреждение Российский Университет Дружбы Народов, г. Москва
2 - Кафедра урологии и андрологии ФФМ МГУ им. М.В.Ломоносова (зав. кафедрой – член-корр. РАМН, профессор, д.м.н., главный уролог департамента здравоохранения г. Москвы А.А. Камалов)
В данной статье показаны патогенетические взаимосвязи таких состояний, как ожирения, дефицита витамина D и бесплодия у мужчин.
Ключевые слова: витамин D, мужское бесплодие, андрогенный дефицит, ожирение.
Состояние вопроса.
Бесплодие-это неспособность сексуально активной, не применяющей контрацептивных средств пары, достигнуть беременности в течение одного года [1]
Бесплодие вообще и, в том числе мужское, на сегодняшний день является национальным бедствием многих стран мира, в том числе и России. И ситуация не стоит на месте - она меняется и не в лучшую сторону: на долю мужского фактора в 2001г. приходилось около 40% причин бесплодия в браке [4], в то время как спустя 10 лет приводятся другие цифры- 48-50% [2].
Проблема бесплодия - это актуальнейшая проблема ХХI века, в котором женское бесплодие уже не превалирует по частоте причин бесплодных браков, как это было в ХХ веке. По последним данным, соотношение женского и мужского бесплодия -50 на 50. В каждой десятой бесплодной паре неспособны к зачатию как супруг, так и супруга.
Несколько раз за последнее десятилетие ВОЗ пересматривались параметры спермы в связи с прогрессирующим снижением числа сперматозоидов в эякуляте: нижняя граница нормы содержания сперматозоидов с 60 млн/мл (Davis, 1943 г.) была уменьшена до 20 млн/мл в 1999 году, а в 2010 до 15 млн/мл [4]. Кроме того, в отрицательной динамике находятся и другие параметры, а именно: уменьшение числа активно-подвижных сперматозоидов, уменьшение числа морфологически нормальных форм [4] .
Несмотря на то, что значение, для жизнедеятельности организма, витамина D стало известно более 100 лет назад, достаточно долгое время его роль сводилась к участию в фосфорно-кальциевом обмене. И только в последнее десятилетие большое многообразие его точек приложения стало понятным и актуальным.
До последнего десятилетия такой фактор, как дефицит витамина D не рассматривался, как состояние, повышающее вероятность развития бесплодия или являющиеся его следствием. Однако, сегодня, все больше данных появляется о важном значении витамина D в созревании сперматозоидов (8,9). Экспрессия рецептора витамина D выявлена в клетках Сертоли, семенных канальцах, придатке яичка, предстательной железе и семенных пузырьках (5,6). В самой крупной на данный момент работе, посвященной влиянию витамина Д на сперматогенез была выявлена взаимосвязь между низким уровнем витамина D и снижением как подвижности, так и количества морфологически нормальных сперматозоидов (8,9). В нескольких работах установлено, что дефицит витамина D может являться одной из причин гипогонадизма у мужчин (8, 9, 10, 11,18). Таким образом, витамин D потенциально может воздействовать на сперматогенез как напрямую, так и опосредованно, влияя на уровень тестостерона. Дефицит витамина D необходимо учитывать при лечении бесплодия у мужчин.
Современный горожанин испытывает агрессивное воздействие окружающей среды, что резко повышает потребность в микроэлементах, антиоксидантах и витаминах.
По данным ряда исследователей распространенность дефицита витамина D в мире составляет не менее 50 % [13,26,31]. В России эта ситуация усугубляется еще и тем, что большая ее часть находится выше 42 параллели, что означает отсутствие достаточного уровня инсоляции в течение 3/4 года и даже в Сочи (рис.1).
Кроме того, современный образ жизни предполагает нахождение в помещении всю светлую часть дня.
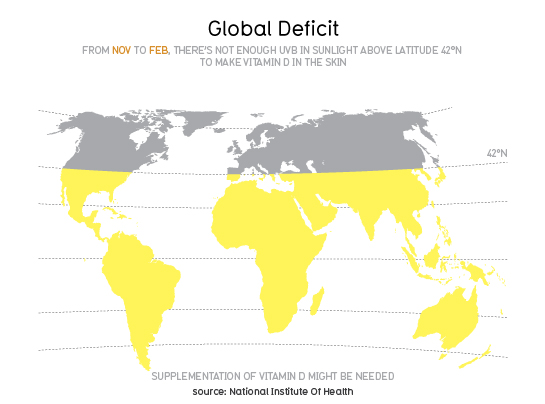
Рис.1 (материал взят с интернет ресурса health.nih.gov-national institute of health)
Другой актуальнейшей проблемой сегодняшнего дня, ассоциированной с бесплодием, является ожирение, которое по мнению ВОЗ названо «эпидемией XXI века». По оценкам ВОЗ, в 2005 г. избыточным весом в мире страдают приблизительно 1,6 миллиарда взрослых людей (в возрасте старше 15 лет) и 400 миллионов имеют ожирение. По прогнозам ВОЗ, к 2015 г. примерно 2,3 миллиарда взрослых людей будут иметь избыточный вес и более 700 миллионов – ожирение, т.е. каждый второй человек на Земле.
Важно учитывать тот факт, что ожирение зачастую сопровождается рядом тяжелых состояний, таких как инсулинорезистентность, гипертоническая болезнь, метаболический синдром и многое другое [14, 16]. Все эти состояния негативно сказываются на репродуктивной функции мужчин и зачастую сопровождаются выраженным дефицитом Д гормона. Патогенетический механизм причинно-следственной связи этих состояний до сих пор остается не до конца изученным и дискутабельным.
Мужчины с увеличенным индексом массы тела (ИМТ), с большей вероятностью будут страдать от бесплодия, чем мужчины с нормальным весом. Как показало исследование Национального института наук о гигиене окружающей среды (National Institute of Environmenta lHealth Sciences) США, превышение веса на 20 фунтов (около 9 кг) увеличивает частоту развития бесплодия на 10%. Исследователи обнаружили, что выходящий за пределы нормы ИМТ является совершенно самостоятельным фактором риска (при этом были исключены другие способствующие бесплодию причины – курение, употребление алкоголя, возраст, повышенный ИМТ у женщины, воздействие пестицидов и растворителей). В целом увеличенный ИМТ мужчины вдвое повышает риск бесплодия независимо от возраста.
Особенно усугубляется это состояние тогда, когда оно сопровождается дефицитом витамина D. Результаты этой взаимосвязи были опубликованы рядом исследователей [5]. Кроме того, низкий уровень витамина D вызывал угнетение сперматогенеза и повышал соотношение фрагментированного ДНК сперматозоидов до 75% [3, 4, 7, 10].
В основе развития нарушений сперматогенеза у мужчин с ожирением, при множестве факторов, лежит главный и основополагающий момент, а именно снижение тестостерона. В избыточном жировом депо увеличивается площадь для «ароматизации» тестостерона, и относительное или абсолютное увеличение эстрогенов проводит к десенситизации гипофиза, что закономерно снижает количество вырабатываемых гонадотропинов. Соответственно, уменьшается выработка тестостерона и тем самым, замыкается порочный круг. Всё выше перечисленное приводит к развитию андрогенного дефицита, что не только поддерживает имеющийся избыток массы тела, но и усугубляет его, так как тестостерон является основным анаболическим гормоном, без достаточной концентрации которого существенно уменьшится физическая активность, роль которой в снижении веса сложно переоценить. В этой связи уместно вернутся к тому, что без достаточной сывороточной концентрации витамина D невозможно обеспечить качественный стероидогенез и, соответственно добиться нормальной фертильности [17,18,20,21,22].
В исследовании, проведенном в Австрии в 2011, приняли участие 165 мужчин (с избыточной массой тела, но без СД 2 типа). Полученные результаты свидетельствовали о том, что ежедневное применение 3332МЕ или 83мкг ежедневно в течении года витамина D, достоверно увеличивали концентрацию тестостерона общ. с 10,7 +-3.9 нмоль/, до 13,4 +- 4.7 нмоль/л; биологически активного тестостерона от 5.21+-1.87 до 6.25+-2.01 нмоль/л; и уровень свободного тестостерона с 0,222+-0.080нмоль/л до 0,267+-0,087нмоль/л. В то же время в группе плацебо существенных изменений не было выявлено [11]
Американские ученые, провели в 2012г. исследование, целью которого было изучение взаимосвязь между качеством спермы, гормональными параметрами и сывороточной концентрацией витамина D (25-гидрокси-витамина D, или 25(OH)D3). Результаты данного исследования убедительно продемонстрировали наличие такой связи, выявили оптимальные концентрации витамина D положительно влияющие на репродуктивные возможности мужчин и наличие отрицательной связи между избыточной массой тела и сывороточной концентрацией 25(OH)D3. В исследование были включены 170 здоровых мужчин, средний возраст которых был 29,0 ± 8,5 лет. Предметом изучения были определены следующие параметры: спермограмма, гормоны крови (общий и свободный тестостерон, глобулин связывающий половые гормоны, эстрадиол, фолликулостимулирующий и лютеинизирующий гормоны); было проведено анкетирование, определен индекс массы тела (составил 24,3 ± 3,2 кг * м (-2)), наличие или отсутствие вредных привычек и определение сывороточной концентрации витамина D. Средняя концентрация 25(OH)D3 составила 34,1 ± 15,06 нг мл (-1). Концентрация сперматозоидов, подвижность сперматозоидов (категории а), их морфология были ниже у мужчин с концентрацией '25(OH)D3 ≥ 50 нг мл по сравнению с мужчинами с уровнем от '20 нг мл и меньше 50 нг мл. Также было выявлено, что общий объем эякулята и общая прогрессивная подвижность сперматозоидов была ниже у мужчин с концентрацией 25(OH)D3 менее 20 нг/мл, по сравнению с мужчинами у которых уровень витамина D был от '20 нг мл и до 50 нг/мл. [10]. Иначе говоря, американские ученые пришли к выводу, что оптимальным уровнем витамина D, положительно влияющим на качество сперматогенеза, является сывороточная концентрация 25(ОН)D3 от 20 до 50 нг/мл. Одинаково негативно сказывается на показателях спермограммы, как высокие показатели уровня 25(ОН)D3, так и его сниженные [10].
Полноценный сперматогенез возможен только при достаточном количестве тестостерона именно в яичках, т.е. собственного гормона, вырабатываемого в собственных яичках. Нарушение сперматогенеза вплоть до выраженной олигоспермии или аспермии может быть связано со снижением функции клеток Лейдига и уменьшением местной концентрации тестостерона. Введение экзогенного тестостерона может изменить картину андрогенного дефицита, но, ни в коем случае не улучшить ситуацию в аспекте сперматогенеза.
Повышение концентрации эстрогенов имеет еще одну точку приложения - достаточное частое повышение уровня пролактина, а он в свою очередь ведет к снижению полового влечения, в связи с чем, у пациентов снижается интенсивность половой жизни, что приводит к застойным явлениям, также негативно влияя на репродуктивную функцию.
Нельзя забывать и о том, что жировая ткань это еще и орган, где происходит синтез гормона Лептина, который также способствует тому, что уровень тестостерона будет неуклонно уменьшаться.
С определенным возрастом, по цифрам которого возникают особенно жаркие споры, человеческая кожа прогрессивно теряет способность к синтезу из 7–дегидрохолестерина витамина D. Именно с этим связывают снижение когнитивных функций у людей в пожилом возрасте, что дает нам основание предположить, что снижение интеллектуальных показателей в любом возрасте так или иначе связано в том числе и с дефицитом витамина D [23, 24, 25,34]
И если влияние ожирения и связанного с ним андрогенного дефицита на параметры сперматогенеза очевидны [14,15,16,18], то определение роли витамина D в развитии этих процессов требует более детального внимания. Для лучшего понимания взаимосвязи ожирения, дефицита витамина D и нарушений сперматогенеза необходимо рассмотреть метаболизм витамина D и его роль в организме человека более подробно.
Метаболизм витамина D (рис2).
D гормон или витамин D это группа секостероидов, объединенных по принципу химического сходства: Витамин D1 (соединение эргокальциферола и люмистерола в соотношении 1:1); Витамин D2 – эргокальциферол; Витамин D3 – холекальциферол, образующийся в организме животных и человека под действием солнечного света из 7–дегидрохолестерина; именно его рассматривают, как «истинный» витамин D, тогда как другие представители этой группы считают модифицированными производными витамина D; Витамин D4 – дигидротахистерол 22,23–дигидроэргокальциферол; Витамин D5 – ситокальциферол (образуется из 7–дегидроситостерола). Сам по себе он не является собственно витамином в классическом смысле этого термина, поскольку оказывает многообразные биологические эффекты за счет взаимодействия со специфическими рецепторами, локализованными в ядрах клеток многих тканей и органов [13, 19].
В нормальных условиях, D–гормон в организме здорового человека образуется ежедневно от 0,3 до 1,0 мкг/сут. [19]. Первая реакция гидроксилирования осуществляется преимущественно в печени (до 90%) и около 10% – внепеченочно при участии микросомального фермента 25–гидроксилазы с образованием промежуточной биологически малоактивной транспортной формы – 25(ОН)D (кальцидол) [19]. Остальные метаболиты витамина D не могут быть использованы в качестве критерия общего количества, как поступившего с пищей, так и образованного в коже. Эта форма может депонироваться в мышечной и жировой тканях, в качестве «неприкосновенного запаса». Последующая реакция 1a–гидроксилирования 25(ОН)D протекает в основном в клетках проксимальных отделов канальцев коры почек при участии фермента 1a–гидроксилазы (25–гидроксивитамин D–1–a–гидроксилаза, CYP27В1) [13, 19, рис.2].

Рис. 2. Vitamin D Deficiency. Michael F. Holick, M.D., Ph.D. N Engl J Med 2007; 357:266-281July 19, 2007DOI: 10.1056/NEJMra070553.
Витамин D естественным образом присутствует лишь в очень ограниченном количестве продуктов питания (см. рис.3).

(рис.3 материал взят с сайта Гарвардской школы здравоохранения hsph.harvard.edu).
В организме человека он вырабатываться только в определенных условиях, когда ультрафиолетовые лучи солнечного света попадают на кожу. Определенные условия это: высота солнцестояния над горизонтом 45°, чистое небо или полупрозрачные облака, достаточное по совокупности объема открытой поверхности кожи, подвергаемой инсоляции минимум 2-3 раза в неделю не менее 15 минут.
Биологически инертный витамин D, образующийся при пребывании на солнце, получаемый из продуктов питания и в виде добавок к пище, для активации в организме должен пройти два процесса гидроксилирования. Первый происходит в печени и превращает витамин D в 25-гидроксивитамин D [25 (OH) D], также известный как кальцидиол - малоактивная (депо) форма витамина D. Второе гидроксилирование происходит преимущественно в почках и его результатом является синтез физиологически активного 1,25-дигидроксивитамина D [1,25 (OH)2 D] или кальцитриола [19, 28, рис. 2].
Из всего выше сказанного складывается неутешительная картина в отношении перспектив улучшения репродуктивной функции мужского населения. А именно: все большее количество мужчин репродуктивного возраста имеют избыточный вес или ожирение; они же, как правило, большую часть времени проводят в закрытых от инсоляций помещениях; кроме того, их принципы питания и физической культуры не способствуют улучшению их показателей ИМТ и нормализации уровня андрогенов, что замыкает развившийся порочный круг- ожирение- андрогенный дефицит- уровень витамина D и в итоге- нарушение репродуктивной функции у мужчин.
Кроме перечисленных патологических состояний дефицит витамина D связывают еще с массой различного рода синдромов и болезней у представителей обоих полов (рис.4)

Рис.4 (Vitamin D Deficiency. Michael F. Holick, M.D., Ph.D. N Engl J Med 2007; 357:266-281July 19, 2007DOI: 10.1056/NEJMra070553). Рисунок адаптирован.
Методы профилактики и коррекции дефицита витамина D (табл.1).
Методы профилактики и коррекции дефицита витамина D и до сих пор вызывают не меньше споров, чем оказываемые им эффекты. В таблице 1 представлены общие рекомендации для всех возрастных групп, мужского и женского полов.
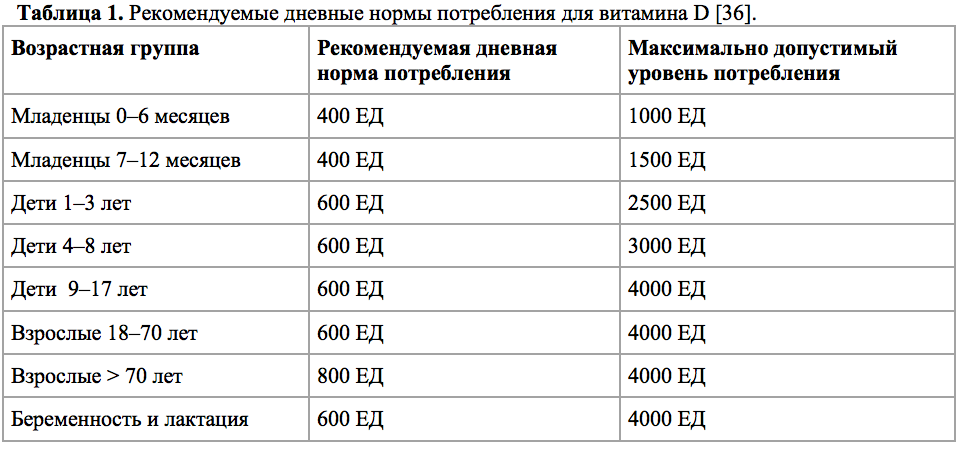
Таблица 1. Рекомендуемые дневные нормы потребления для витамина D [36].
Рекомендуя применение препаратов витамина D для коррекции дефицита данного вещества необходимо отталкиваться от его исходного уровня, наличия или отсутствия нарушений функции органов ЖКТ и почек, уровнем метаболизма, выбора между активными метаболитами D3 или препаратами нативных витаминов D2 и D3, водного или масляного растворов. Мнения многих авторов по поводу оптимальных дозировок существенно разнятся [12, 27,28,29,30,32, 33,35,36]. Применение в течение года у мужчин витамина D в количестве 83 мкг (около 3332МЕ) ежедневно достоверно повышало уровень тестостерона, а значит благоприятно сказывалось на репродуктивную систему мужчин в целом [11, 21]. Надо учитывать тот факт, что наличие ожирения существенно увеличит потребность в витамине D и назначаемая доза должна быть выше. Как мы уже и говорили ранее, важно не только ликвидировать недостаток витамина D, но и не допустить его избыток.
Множество споров вызывает вопрос токсичности препаратов, содержащих различные формы витамина D и предельно допустимые его дозы. По данным ряда авторов [27], у здоровых взрослых, 5 месяцев приема 10 000 МЕ/сут витамина D не приводило ни к гиперкальциемии, ни к увеличению экскреции кальция с мочой, которая является наиболее чувствительным индикатором для выявления потенциального токсического влияния витамина D, что подтверждает рациональность максимально допустимого уровня потребления для взрослых 10 000 МЕ/сут.
На основании всего вышеизложенного при выявлении нарушения репродуктивной функции, особенно в сочетании с избыточной массой тела или ожирением необходимо определять уровень сывороточной концентрации витамина D и своевременно корректировать его дефицит. Кроме того, необходимо помнить, что компенсация только одного дефицита витамина D, не сможет решить весь тот комплекс проблем, который, как правило, имеет место быть у пациентов с нарушенной репродуктивной функцией. К сожалению, изменение пищевого поведения и введение в режим дня физических нагрузок, зачастую также не решают полностью проблем с избыточной массой тела и не смогут нивелировать андрогенный дефицит, если он имеет место быть. В тот же момент, при не соблюдении принципов правильного питания и отсутствии мышечного «каркаса», медикаментозная терапия будет не вполне эффективной. Своевременно компенсированный дефицит витамина D – залог эффективного лечения ожирения и бесплодия, при условии комплексной терапии всех имеющихся нарушений.
VITAMIN D DIFICIENCY AND MALE INFERTILITY
ACTUAL PROBLEMS OF THE 21st CENTURY: MALE INFERTILITY, OBESITY AND VITAMIN D – IS THERE A RELATIONSHIP?
SUMMARY
In the last half century humanity is rapidly gaining weight and loosing reproductive abilities. The quality and of sperm parameters a constantly getting worse.
Somatic diseases (diabetes, obesity, metabolic syndrome, hypertension etc.) get significantly younger. In addition to the medical aspects the environmental factors and food quality may be harmful for reproductive function. The lack of some substances can not only cause discomfort or functional impairment and lead to serious metabolic disturbances including the loss of some functions or the development of pathological conditions that threaten the life of the organism or its reproduction.
The role of vitamin D in the human body can hardly be overestimated. Vitamin D receptors are found in all body tissues including testicular tissue. Since the end of last century a great number of medical researches was aimed at indentifying the pathogenic mechanism of some diseases, including endocrine disorder and vitamin D deficiency. This article shows the pathogenetic relationships of such conditions as obesity, vitamin D deficiency and male infertility.
Key words: vitamin D, male infertility, obesity, androgen deficiency.
Литература
1. World Health Organization: Report of the Meeting on the Prevention of Infertility at the Primary Health Care Level. WHO, Geneva 1983, WHO/MCH/1984.4
2. Нишлаг Э., Андрология. Мужское здоровье и дисфункция репродуктивной системы. Нишлаг Э., Г.М. Бере. //ООО «Медицинское информационное агентство», 2005
3. Тишова Ю.А. Роль коррекции дефицита тестостерона в лечении метаболического синдрома у мужчин. Тишова Ю.А., Калинченко С.Ю., Мсхалая Г.Ж. //Ж. Ожирение и метаболизм, 2009,№2
4. WHO laboratory manual for the examination and processing of human semen - 5th ed. World Health Organization 2010
5. Lerchbaum E. Vitamin D and fertility: a systematic review. Lerchbaum E., Obermayer-Pietsch B. //European Journal of Endocrinology (2012) 166 765–778.
6. Panagiotis A. Vitamin D in human reproduction: a narrative review. Panagiotis A., Spyridon Karras, Dimitrios G. Goulis.// Int J Clin Pract. 2013 Mar;67(3):225-35
7. Blomberg Jensen M. Vitamin D receptor and vitamin D metabolizing enzymes are expressed in the human male reproductive tract. Blomberg Jensen M, Nielsen JE, Jørgensen A et al. //Hum Reprod 2010; 25: 1303–11
8. Walters MR. 1,25-dihydroxyvitamin D3 receptors in the seminiferous tubules of the rat testis increase at puberty. //Endocrinology 1984; 114: 2167–74.
9. Blomberg Jensen M. Vitamin D is positively associated with sperm motility and increases intracellular calcium in human spermatozoa. Blomberg Jensen M, Bjerrum PJ, Jessen TE, Nielsen JE, Joensen UN, Olesen IA, Petersen JH, Juul A, Dissing S, Jørgensen N. //Human Reproduction 2011 26 1307–1317.
10. Lee DM. Association of hypogonadism with vitamin D status: the European Male Ageing Study. EMAS study group. Lee DM, Tajar A, Pye SR et al. //Eur J Endocrinol 2012; 166: 77–85
11. Pilz S. Effect of vitamin D supplementation on testosterone levels in men. Pilz S, Frisch S, Koertke H et al. //Horm Metab Res 2011; 43: 223–5
12. Марова Е.И. Дефицит витамина D и его фармакологическая коррекция . Марова Е.И., Родионова С.С., Рожинская Л.Я., Шварц Г.Я. Альфакальцидол (Альфа–Д3) в профилактике и лечении остеопороза. Метод. рекомендации. М., 1998.– 35с. Eular Publishers, Basel, 1996 – 139 p.
13. Holick M.F. Sunlight, UV-radiation, vitamin D and skin cancer: how much sunlight do weneed? // Adv. Exp. Med. Biol. - 2008. - Vol. 624. - P.1 - 15
14. Wortsman J. Decreased bioavailability of vitamin D in obesity. Wortsman J, Matsuoka LY, Chen TC, Lu Z, Holick MF// Am J ClinNutr. 2000 Sep;72(3):690-3.
15. Kahn B.B. “Obesity and insulin resistance”. Kahn B.B. Jeffrey S.Flier.// J.ClinInvest. Volume 106, Issue 4 (August 15, 2000),106 (4):473-481. Doi:10.1172/JCI10842.
16. Wortsman J. Decreased bioavailability of vitamin D in obesity. Wortsman J, Matsuoka LY, Chen TC, Lu Z, Holick MF. //Am J ClinNutr. 2000 Sep;72(3):690-3.
17. Corbett ST. “Vitamin Areceptor found in human spem”. Corbett ST, Hill O, Nangia AK. // Journal of Urology 2006, Dec., 68 (6): 1345-9.
18. Elisabeth Lerchbaum. Vitamin D and fertility: a systematic review. Elisabeth Lerchbaum, Barbara Obermayer-Pietsch; //European Journal of Endocrinology (2012) 166 765-778
19. Michael F. Holick, M.D., Ph.D. Vitamin D Deficiency. //N Engl J Med 2007; 357:266-281July 19, 2007DOI: 10.1056/NEJMra070553.
20. Nimptsch K. Association between plasma 25-OH vitamin D and testosterone levels in men. Nimptsch K, Platz EA, Willett WC, Giovannucci E. // Clin Endocrinol (Oxf) 2012; 77: 106–12
21. Pilz S. “Effect of vitamin D supplementation on testosterone levels in men”. Pilz S., Frisch S., Koertke H., Kuhn J, Dreier J., Obermayer-Pietsch B., Wehr E., Zittermann A. //HormMetabRes. 2011 Mar; 43(3): 223-5.
22. Ahmad.O.Hammoud. Association of 25-hydroxy-vitamin D levels with semen and hormonal parameters. Ahmad.O.Hammoud, A.Wayne-Meikle, C.Matthew- Peterson, Joseph Stanford, Mark Gibson, Douglas T Carrell. USA. //Asian J Androl. 2012 Oct 8;: 23042450
23. MacLaughlin J. Aging decreases the capacity of the human skin to produce vitamin D3. MacLaughlin J, Holick MF. // J Clin Invest 1985; 76:1536–1538.
24. Annweiler C. Cognitive effects of vitamin D supplementation in older outpatients visiting a memory clinic: a pre-post study. Annweiler C, Fantino B, Gautier J, Beaudenon M, Thiery S, Beauchet O.// J Am Geriatr Soc. 2012 Apr;60(4):793-5.
25. Mosekilde L. Vitamin D and the Elderly.//Clin Endocrinol. 623: 265-281; (2005).
26. Youm T. Do all hip fractures result from a fall? Youm T, Koval KJ, Kummer FJ et al.// Am. J Ortop. 28: (1999).
27. Калинченко С.Ю. «Витамин Д и мочекаменная болезнь». Калинченко С.Ю.,Пигарова Е.А., Гусакова Д.А., Плещева А.В., //Concilium 2012.
28. Zehnder D. Extrarenal expression of 25-hydroxyvitamin D3-1alphahydroxylase /Zehnder D., Bland R., Williams M.C. et. al.// Journal of Clinical Endocrinology and Metabolism, 86, (2001).
29. Holick MF. Vitamin D: the underappreciated D-lightful hormone that is important for skeletal and cellular health. //CurrOpinEndocrinol Diabetes 2002;9:87-98.
30. Heaney RP. Human serum 25-hydroxycholecalciferol response to extended oral dosing with cholecalciferol. Heaney RP, Davies KM, Chen TC, Holick MF, Barger-Lux MJ. Am J Clin Nutr 2003; 77:204–210.
31. Malaya Gupta. Antitumor activity and antioxident role of Bauhinia racemosa against Ehrlich ascites carcinoma in Swiss albino mice. Malaya Gupta, Upal Kanti Mazumder, Ramanathan Sambath Kumar, Thangavel Siva Kumar. //Acta Pharmacol Sin 2004 Aug; 25 (8): 1070-1076
32. Dukas L. Alfacalcidol Reduces the Number of Fallers in a Community-Dwelling Elderly Population With a Minimum Calcium Intake of More Than 500 Mg Daily. Dukas L., Bischoff H. A., Lindpaintner L. S. et al. //J Am Geriatr. Soc 52(2), (2004).
33. Gallagher JC. Combination treatment with estrogen and calcitriol in the prevention of age-related bone loss. Gallagher JC, Fowler SE, Detter JR et al.//J Clin Endocrinol Metab;86, (2001).
34. Nordin BEC. The special role of "hormonal forms" of vitamin D in treatment of osteoporosis/, Need AG, Morris HA et al.// Calcif Tissue Int;65, (1999).
35. Tsugeno H. Assessment of Etidronic Acid Plus Alfacalcidol for the Treatment of Osteopenia in Steroid-Dependent Asthmatics. Tsugeno H., Nakai M., Okamoto M. et al.//Clin Drug Invest 23(2), (2003).
36. Institute of Medicine, Food and Nutrition Board. Dietary Reference Intakes for Calcium and Vitamin D. Washington, DC: National Academy Press, 2010.
СПРАВКА ОБ АВТОРАХ:
1. Павлова Зухра Шариповна, кандидат медицинских наук, докторант кафедры эндокринологии ФПК МР РУДН, тел 8 985 410 81 25, электронная почта zukhra73@gmail.com
2. Тишова Юлия Александровна, кандидат медицинских наук, доцент кафедры эндокринологии ФПК МР РУДН, тел 8 903 221 32 76, электронная почта tishova@proandro.ru
3.Калинченко Светлана Юрьевна, доктор медицинских наук, профессор кафедры эндокринологии ФПК МР РУДН, тел 8 926 605 13 69, электронная почта kalinchenko@list.ru
4. Гусакова Дарья Александровна, научный сотрудник ФГБУ «НИИ Урологии» МЗ РФ, тел. 8 926 993 73 72, электронная почта dariagusakova@gmail.com
5. Жуйков Александр Владимирович, врач эндокринолог клиники профессора Калинченко, г.Москва, 8 915 350 43 37, электронный адрес alex-zh36@mail.ru
16 Мая 2016